 Votre magazine
Votre magazine
numérique !
N°176
décembre 2023
Se soigner
Dossier - XENOGREFFE
Les promesses de la xénotransplantation
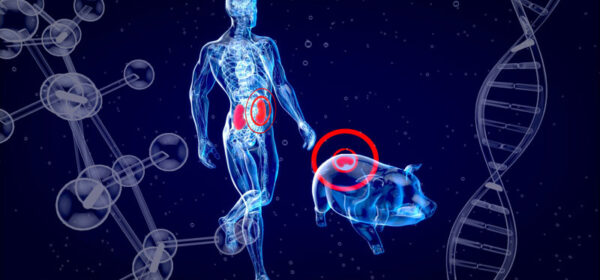
Depuis quelques années, nous arrivent depuis l'autre côté de l'Atlantique des nouvelles d'opérations improbables : des cœurs et des reins de porcs sont greffés sur des humains dans le cadre d'expériences médicales. Les avancées en matière de xénotransplantation – du grec xenos qui signifie "étranger, étrange, hôte" - autrement dit la transplantation à un patient d'un greffon provenant d'une espèce biologique différente de la sienne, sont considérables.
Les chiffres nous sont devenus hélas familiers : chaque année, rien que pour les reins, 12 000 personnes sont dans l'attente d'une greffe mais seulement 3 à 4 000 peuvent en bénéficier. Devant ce manque chronique d'organes - pénurie encore exacerbée par la récente pandémie de Covid 19 – les recherches en xénotransplantation se sont multipliées suscitant dans le même temps l'espoir et un nombre considérable de questions, scientifiques bien sûr mais aussi sanitaires, éthiques et juridiques. Cette thérapeutique qui estompe les frontières entre espèces donne plutôt le vertige. Il n'empêche qu'on se prend à rêver : dans un futur proche, en cas de défaillance d'organe, un petit cochon vous donnera-t-il gracieusement le sien pour le remplacer ?
Une longue histoire d'espoirs déçus
L'idée d'aller chercher chez d'autres espèces les organes qui nous font défaut ne date pas d'hier. Dès 1667, un patient téméraire se fait transfuser du sang d'agneau. Au 19e siècle, des hommes se font greffer des cornées de porc tandis que l'armée britannique expérimente la peau de grenouille pour réparer les grands brûlés. En 1905, c'est au tour d'un rein de chèvre d'être transplanté sur une femme souffrant d'insuffisance rénale. Est-il nécessaire de préciser que toute ces tentatives ne se soldent pas très bien pour les patients ? Mention spéciale pour le chirurgien Serge Voronoff qui, dans les années 1920, lance une étonnante mode de greffes de testicules de chimpanzés sur de vieux messieurs financièrement à l'aise afin de leur faire retrouver vigueur et vitalité. L'objectif n'est pas uniquement sexuel mais vise plus globalement au relèvement des forces physiques comme à l'amélioration des facultés intellectuelles.

Jusqu'en 1939, plus de 5 000 hommes dans le monde tenteront l'aventure ! Les choses sérieuses commencent dans les années 1960 avec la découverte de médicaments immunosuppresseurs comme la cyclosporine qui vont initier toute une vague de greffes expérimentales d'organes de singe sur l'humain : en 1964, à une époque où la dialyse en est encore à ses balbutiements, six patients atteints d'insuffisance rénale terminale se font transplanter des reins de chimpanzés. Parmi eux, une jeune femme parvient à survivre neuf mois. La même année, c'est un Américain à qui l'on greffe un cœur de chimpanzé.
Il meurt deux heures après l'opération. Puis un bébé de 15 jours souffrant d'une maladie cardiaque reçoit un cœur de babouin et survit encore trois semaines.
Du singe au cochon
Pendant longtemps, les primates non humains ont été les donneurs d'organes privilégiés en raison d'une grande similarité génétique avec l'homme et donc d'une immunologie très proche. En revanche, on s'est bientôt rendu compte que cette proximité accentuait considérablement le risque de transmission d'agent infectieux à l'être humain. Le virus du SIDA dont on a récemment prouvé l'origine simienne est l'exemple le plus frappant de ces agents facilement transmissibles du singe à l'homme.
Aujourd'hui, le porc est considéré comme l'animal-ressource le plus prometteur.
Par ailleurs, la plupart de ces primates étant en voie de disparition ou en tout cas protégés, il est bientôt devenu clair qu'ils ne pourraient constituer une source pérenne d'organes de remplacement. Les chercheurs se sont alors tournés vers des espèces un peu plus éloignées de l'humain, notamment le porc qui présente de nombreux avantages : d'abord une similarité anatomique et une taille proche de la nôtre (il est possible d’obtenir un organe d’une dimension adéquate avant six mois) ; ensuite une longue tradition d'élevage associée à une fertilité intarissable. Aujourd'hui, le porc est considéré comme l'animal-ressource le plus prometteur.
La hantise du rejet
L'obstacle le plus important en matière de greffe, c'est le risque de rejet. L'organe transplanté va dès le moment de la greffe faire l'objet d'une cascade de mécanismes immunitaires. Il risque d'être traité comme une infection et d'être attaqué par le système immunitaire. La réaction de rejet est encore plus aiguë si le greffon est d’origine animale, puisque les systèmes immunologiques du donneur et du receveur sont encore beaucoup plus éloignés. D'autres barrières immunologiques, inter-espèces celles-ci, rentrent en jeu. Les anticorps de l'humain, présents naturellement dans la circulation sanguine vont se diriger contre les antigènes présents à la surface des cellules de l'organe animal et peuvent ainsi occasionner un "rejet hyper aigu" c'est-à-dire un rejet dans les minutes suivant la greffe.
Suite à l'agrégation de plaquettes sanguines dans les vaisseaux, l'organe coagule de l'intérieur, se congestionne de façon massive et brutale, et devient noir en quelques minutes.
La prise de médicaments immunosuppresseurs permet de maîtriser l'immunité cellulaire et de repousser le rejet à quelques jours après la greffe. On parle alors de "rejet aigu". Lorsque le greffon demeure fonctionnel plus longtemps et n'est rejeté qu'à plus long terme, des semaines voire des mois, le rejet est alors "chronique". Bien souvent on en ignore la cause exacte. Réponse immunitaire ? Phénomène infectieux ? Toxicité du traitement immunosuppresseur ? Un cumul des trois ? Difficile à dire. Le rejet sur le long terme demeure une problématique majeure.

Les biotechnologies pour repousser le rejet
En xénotransplantation comme en allogreffe, un traitement immunosuppresseur chez le receveur est primordial pour ne pas agresser le greffon avec pour inconvénient l'affaiblissement du système immunitaire et le risque plus élevé d'infection. Le succès repose sur un équilibre entre une immunosuppression suffisante et une préservation minimale des défenses de l'organisme pour combattre les infections. Mais lorsque le greffon vient d'une autre espèce, le porc par exemple, cela ne suffit pas. Un traitement de l'animal donneur s'avère nécessaire. Les dernières recherches ont montré que la solution au problème de rejet immédiat passait par des modifications génétiques.
« L'idée générale est de supprimer l'expression de certains antigènes à la surface des cellules de l'organe du porc jusqu'alors reconnues comme étrangères par le corps humain » explique Valentin Goutaudier, néphrologue, chercheur à l’Institut de Transplantation et de Régénération d’Organes de Paris PITOR (Université Paris Cité, INSERM, AP-HP). « Cela est désormais possible grâce aux nouvelles biotechnologies qui permettent de modifier le génome porcin : il est possible de supprimer en particulier les gènes du porc à l'origine de la fabrication d'enzymes responsables de la formation de xénoantigènes (des sucres), ceux-là mêmes qui, une fois présents dans l’organisme humain, induisent une très forte réaction immunitaire du receveur. »
Un traitement de l'animal donneur s'avère nécessaire. Les dernières recherches ont montré que la solution au problème de rejet immédiat passait par des modifications génétiques.
Mais ce n'est pas tout, il s'agit aussi de bloquer les effets des hormones de croissance et d’empêcher un développement inconsidéré de l’organe. Enfin, des signes humains sont rajoutés, et agissent comme un filet de camouflage, dissimulant les cellules du porc pour qu'elles ne soient pas repérées par le système immunitaire de l'humain. Les progrès récents en matière de génie génétique rendent aujourd'hui possibles toutes ces modifications de l'ADN porcin. « Le dernier rein utilisé par une équipe de l'université d'Alabama a vu dix de ses gènes modifiés » précise Valentin Goutaudier « trois pour empêcher l'expression des sucres, six ajoutés pour inhiber l'inflammation et la coagulation et un dernier qui supprime l'hormone de croissance ».
Il y a tant de gènes impliqués dans les mécanismes de rejet que la production d'animaux génétiquement modifiés répondant aux critères nécessaires pour offrir des greffons compatibles avec l'humain est une opération extraordinairement compliquée. Sans compter qu'ensuite, il reste à élever ces porcs transgéniques dans des conditions sanitaires irréprochables, avec de l'eau filtrée, traitée, une nourriture stérilisée, servie par des soigneurs en combinaison aseptisée. Et tout cela coûte cher, très cher : compter de 300 à 500 000 dollars (281 000 à 469 000 euros) pour un porc transgénique !
Prolongez votre lecture !
Cela peut vous intéresser
 Se soigner
Se soigner
Vaccination contre le Covid

